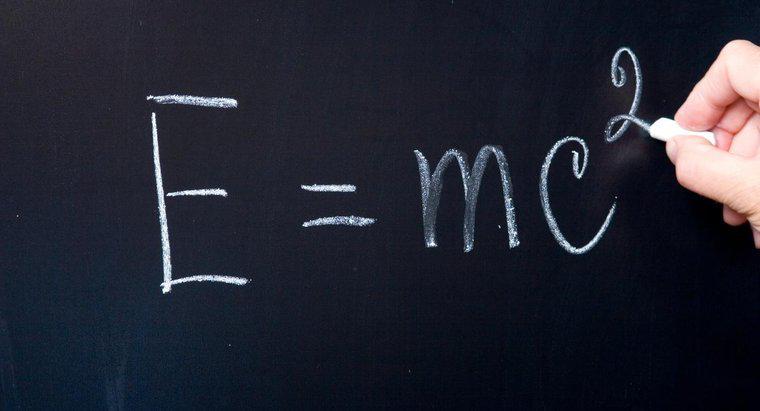Il "più alto livello di energia occupata" indica il livello di energia in cui risiedono gli elettroni di valenza. Gli elementi seguono la regola dell'ottetto, nel senso che vogliono raggiungere la disposizione stabile di avere otto elettroni nella loro massima occupazione livello di energia. Alcuni atomi vogliono rinunciare agli elettroni, e altri vogliono guadagnare elettroni per diventare più stabili.
Gli elettroni di valenza esistono solo negli orbitali s e p del massimo livello di energia. Il principio Aufbau afferma che gli elettroni devono riempire i livelli di energia più bassi prima di passare al livello di energia successivo. Ogni livello di energia ha un numero specifico di orbitali; solo due elettroni che ruotano in direzioni opposte possono riempire ciascun orbitale. Gli elettroni esistono a diverse distanze dal nucleo dell'atomo. Questi elettroni che occupano orbitali più vicini al nucleo hanno un'energia inferiore a quelli che orbitano più lontano.
Gli elementi più stabili della tavola periodica, i gas nobili, hanno otto elettroni nel loro più alto livello di energia occupata; i gas nobili non formano facilmente composti con altri elementi. Gli elettroni nel più alto livello di energia occupata hanno molto a che fare con la reattività dell'elemento. Elementi come i metalli con pochi elettroni nei loro più alti livelli di energia vogliono donarli ad altri elementi. Elementi come i non metalli hanno quasi un complemento completo di otto elettroni nei loro livelli di energia più esterni, quindi vogliono ottenere elettroni dagli elementi.