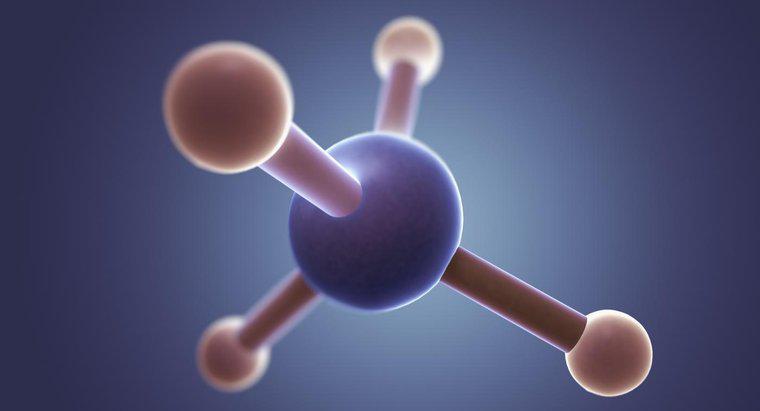
Il cloruro di metile (CH3Cl) ha una forma tetraedrica con un angolo di legame di 109,5 gradi. Questo perché il carbonio ha quattro elettroni di valenza che formano quattro legami e in uno spazio tridimensionale, una forma tetraedrica consente agli elettroni legati di essere più distanti l'uno dall'altro.
Le forme molecolari sono previste usando la teoria della repulsione delle coppie di elettroni della valenza (VSEPR). Secondo VSEPR, le molecole avranno una forma geometrica che consente ai loro centri di carica negativi (elettroni legati e a coppie solitari) di essere il più lontano possibile l'uno dall'altro, a causa della reciproca repulsione delle cariche negative. Le molecole con due centri negativi tendono ad essere lineari (un angolo di legame di 180 gradi in un piano bidimensionale). Le molecole con tre centri negativi sono planari trigonali (angoli di legame di 120 gradi in un piano bidimensionale) e le molecole con quattro centri negativi sono tetraedriche (angoli di legame di 108,5 gradi in uno spazio tridimensionale).
Il cloruro di metile ha un atomo di carbonio centrale circondato da quattro singoli legami (tre per idrogeno e uno per cloro). Pertanto, secondo VSEPR, la molecola avrà una forma tetraedrica con un angolo di legame di 108,5 gradi per consentire la massima separazione degli elettroni legati.