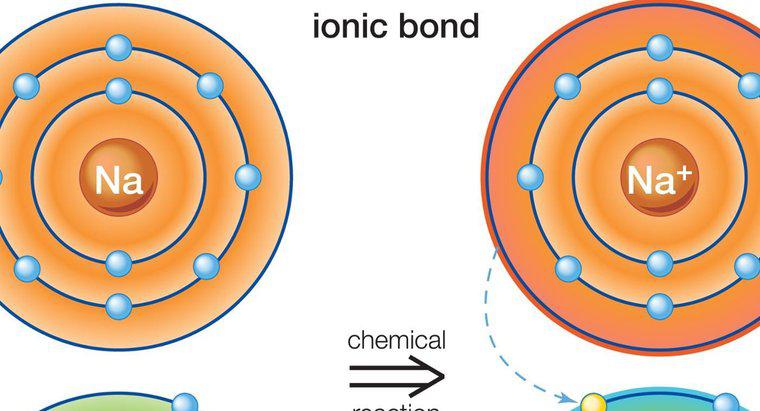
Gli atomi più grandi con orbitali di elettroni complessi, come quelli trovati nei metalli di transizione, sono in grado di superare la regola dell'ottetto nelle giuste condizioni. In particolare, questi si verificano quando gli elementi più pesanti sono legati a piccoli elementi altamente elettronegativi come fluoro, cloro o ossigeno. Un esempio è il pentacloruro di fosforo, un singolo atomo di fosforo legato a cinque atomi di cloro, che ha 10 elettroni condivisi nel suo guscio di valenza esterno.
Quando un elemento ha un numero atomico sufficientemente alto, è disponibile un nuovo tipo di orbitale di elettroni con una capacità massima di 10 elettroni, che consente fino a cinque singoli legami. Questo è ciò che accade con il pentacloruro di fosforo. Per utilizzare questo orbitale, tuttavia, la reazione che crea il composto che utilizza questo orbitale deve essere molto energeticamente favorevole. Ecco perché, per farlo funzionare, devono essere coinvolti elementi con una capacità molto forte di attrarre e legare gli elettroni, noto anche come elettronegatività. L'ossigeno ha un'elevata elettronegatività, ma è improbabile che crei un composto con cinque atomi legati come fa il cloro, perché richiede due elettroni per completare il suo guscio di valenza esterno. Il fluoro e il cloro ne richiedono solo uno e quindi rendono più probabile questo tipo di configurazione.