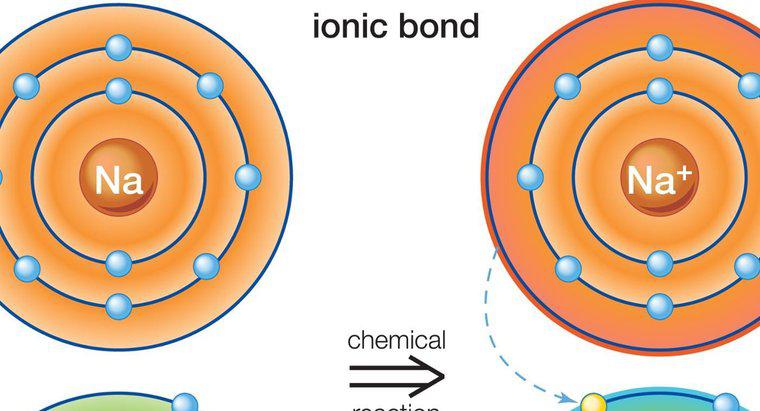
I composti ionici si formano quando gli elettroni si trasferiscono da un atomo all'altro. I composti covalenti si formano quando gli atomi condividono gli elettroni, con conseguente perdita netta o guadagno di elettroni come si vede nei composti ionici.
Quando due o più elementi chimici diversi si combinano, formano un composto. Il modo in cui quegli atomi si combinano o si uniscono tra loro dipende dall'elemento e dalle sue caratteristiche. Il legame che tiene insieme gli atomi determina il tipo di composto che è, e questi possono essere ionici o covalenti.
Nozioni di base sull'associazione Gli atomi sono classificati e caratterizzati dal numero di elettroni che contengono. Ogni elemento ha un diverso numero di elettroni alloggiati negli orbitali attorno al nucleo. L'orbitale esterno è noto come orbitale di valenza e questi elettroni sono quelli usati nel processo di legame. Ogni atomo cerca di avere un orbitale esterno completo di elettroni per essere stabile. Per la maggior parte degli atomi, questo orbitale esterno contiene otto elettroni. La regola dell'ottetto si riferisce al requisito degli elettroni di guadagnare, perdere o condividere elettroni per riempire l'orbitale esterno. Quando gli atomi guadagnano o donano elettroni a un altro elemento, formano composti ionici. Quando gli atomi condividono gli elettroni con un altro elemento, formano composti covalenti.
Composti ionici
Composti ionici si formano tra metalli e non metalli. I metalli hanno in genere pochi elettroni di valenza nell'orbitale esterno mentre i non metalli hanno molti. Il metallo agisce come un donatore e trasferisce i suoi elettroni di valenza al non metallo, soddisfacendo così la regola dell'ottetto necessaria per formare un atomo stabile. Ciò si traduce in un atomo di metallo caricato positivamente e un atomo non metallico caricato negativamente, noto come ioni. A causa delle cariche opposte, i due ioni sono attratti l'un l'altro e rimangono vicini tra loro, formando così un composto ionico. Più di un elettrone può essere trasferito in questo processo. Poiché gli atomi caricati fluttuano liberamente, sono attratti da altri atomi con la carica opposta, non solo dal singolo atomo da cui hanno donato o ricevuto elettroni.
Le caratteristiche dei composti ionici sono che sono solidi cristallini con punti di fusione e di ebollizione elevati. Conducono elettricità quando sono fusi e sono solubili in acqua ma non liquidi non polari. Uno dei composti ionici più comuni è il cloruro di sodio (NaCl), noto anche come sale da cucina.
Composti covalenti
Al contrario, i composti covalenti si verificano tipicamente tra non metalli o due atomi degli stessi elementi o di elementi simili. Gli atomi con elettronegatività simili, che possono essere determinati dalla tavola periodica, tendono ad attrarsi l'un l'altro e formano legami covalenti. Piuttosto che trasferire gli elettroni di valenza completamente, gli atomi condividono gli elettroni esterni per soddisfare la regola dell'ottetto. Gli elettroni condivisi possono muoversi avanti e indietro tra gli atomi legati. Nessuno dei due atomi sta guadagnando o perdendo un elettrone in questo tipo di legame, quindi non si formano ioni. Per questo motivo, gli atomi nel composto non sono attratti da altri atomi nelle vicinanze come quelli visti nei composti ionici.
I composti covalenti possono essere solidi, liquidi o gas. Tendono ad essere cattivi conduttori elettrici e hanno punti di fusione e di ebollizione bassi. Tendono ad essere solubili in liquidi non polari ma non in acqua. Alcuni esempi comuni di composti covalenti sono il metano (CH4) e il biossido di carbonio (CO2).