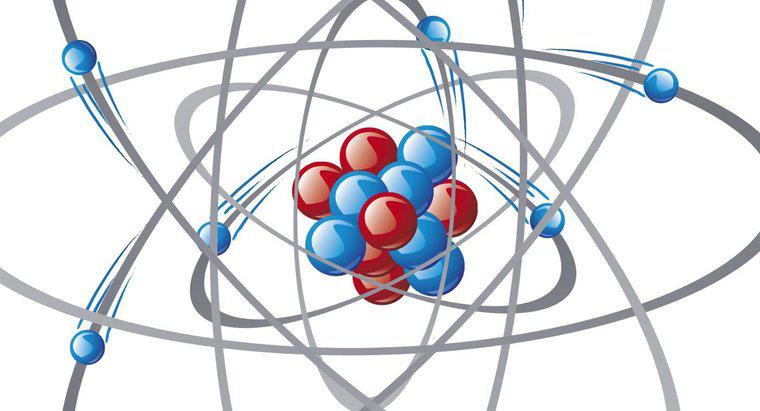
La nuvola di elettroni è un modo di visualizzare i risultati di equazioni matematiche utilizzate per calcolare la posizione di un elettrone mentre orbita intorno al nucleo dell'atomo. L'area in cui la nuvola è più densa descrive il più probabile posizione dell'elettrone in un determinato momento.
Gli scienziati usano molti diversi modelli di atomi per capire il loro comportamento e l'interazione con altri materiali. Il modello Bohr del 1913 descrive l'atomo come cerchi concentrici di orbitali di elettroni caricati negativamente che circondano il nucleo caricato positivamente, ma non è in grado di spiegare i risultati sperimentali di Erwin Schrödinger del 1926 sparando particelle cariche attraverso una fessura in lamina d'oro. Il modello della nuvola di elettroni, con elettroni in grado di muoversi attraverso gli orbitali con energie e forme caratteristiche, fornisce una migliore corrispondenza per i dati sperimentali. L'equazione di Schrödinger, con un'infinità di soluzioni, predice sia la forma che la densità della nuvola. Il modello tiene conto anche del principio di indeterminazione di Heisenberg. Il modello di nube di elettroni, così come il modello di Bohr, considera gli atomi come costituiti solo da particelle cariche positivamente e negativamente. La scoperta del neutrone del 1932 portò a un ulteriore affinamento del modello. Dal 1932, gli scienziati continuano a scoprire ulteriori particelle nell'atomo, portando a cambiamenti nelle descrizioni atomiche.