I composti ionici conducono elettricità quando si dissolvono in acqua perché il movimento delle loro particelle caricate negativamente e con carica positiva forma una corrente elettrica, spiega About.com. In questo stato liquido, gli ioni caricati separano e muoversi liberamente, creando una corrente di particelle elettriche che conducono elettricità.
La conduttività elettrica misura la capacità di una sostanza di produrre una corrente elettrica, mentre l'elettricità è il movimento di particelle cariche che formano quella corrente elettrica. Una corrente, nel regno elettrico, è semplicemente un flusso di cariche che richiede libertà di movimento. Perché si formi la corrente elettrica, devono essere presenti sia il movimento che la conduttività.
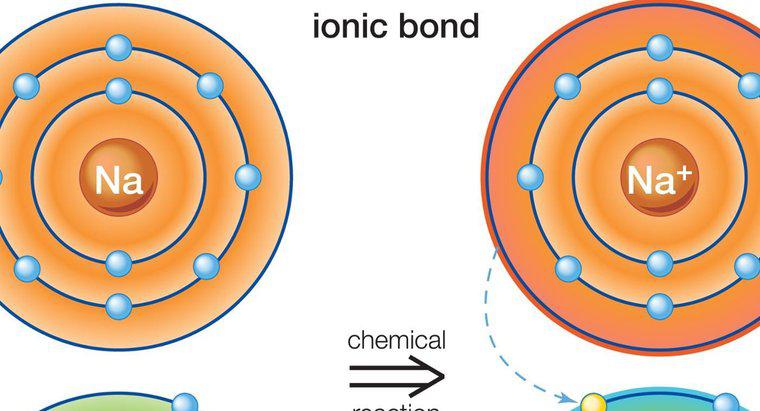
I composti ionici si formano quando gli ioni caricati positivamente e negativamente sono legati strettamente insieme. Questi ioni sono atomi che hanno guadagnato o perso un elettrone e si uniscono trasferendo un elettrone in un processo chiamato legame ionico. Uno ione con carica positiva è un catione, mentre uno ione con carica negativa è un anione. Un esempio di un composto ionico è il cloruro di sodio, NaCl, in cui il sodio (NA) è il catione e il cloro (Cl) è l'anione.
I composti ionici nel loro stato solido hanno particelle che sono tenute insieme strettamente, limitando tutti i movimenti e impedendo la formazione di corrente elettrica. Di conseguenza, i solidi ionici non conducono elettricità. Una volta sciolto in acqua, il legame ionico viene rotto, il che consente di separare gli ioni caricati e di fluire liberamente. L'acqua fornisce il movimento delle particelle e gli ioni separati forniscono la conduttività. Dal momento che entrambi sono presenti, viene creata una corrente elettrica per condurre l'elettricità.