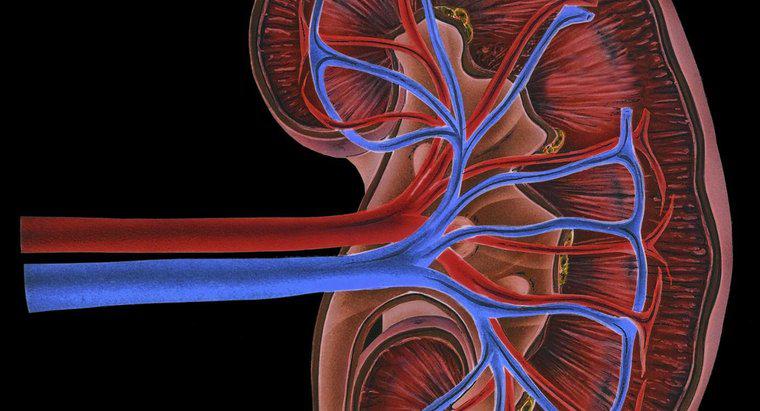
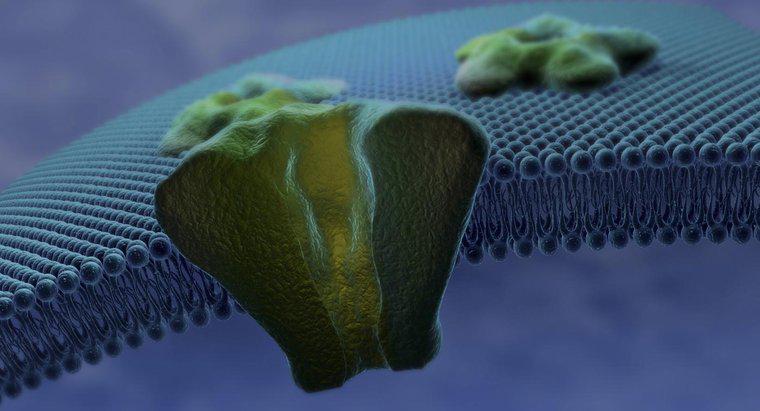
I metalli tendono a formare ioni positivi perché contengono meno di quattro elettroni nei loro gusci più esterni, rendendolo energicamente favorevole alla perdita di questi elettroni e alla struttura elettronica del gas nobile più vicino. Ingrandimento gli atomi con meno elettroni nella parte più esterna perdono elettroni più facilmente.
Il gruppo IA è il gruppo più metallico nella tavola periodica, contenente i metalli alcalini. Questi elementi perdono facilmente i loro singoli elettroni più esterni, cambiando in ioni positivi con la configurazione elettronica del precedente gas nobile. Il movimento verso il basso nel gruppo IA è accompagnato da un aumento della reattività degli elementi quando aumenta il numero di elettroni nei gusci, facendo sì che gli atomi aumentino. Gli elettroni di valenza degli atomi con elementi che hanno raggi atomici più grandi e più gusci interni sono meno attratti dalla carica nucleare. Ciò consente loro di lasciare l'atomo più facilmente rispetto ai loro omologhi più piccoli.
Il numero di elettroni più esterni aumenta da sinistra a destra nella tavola periodica. Il gruppo IIA è il gruppo adiacente all'IA nella tavola periodica. Contiene i metalli delle terre alcaline, che contengono due elettroni nei loro gusci più esterni. Con l'aumentare del numero di elettroni, aumenta anche la facilità di perdere questi elettroni per diventare ioni positivi.