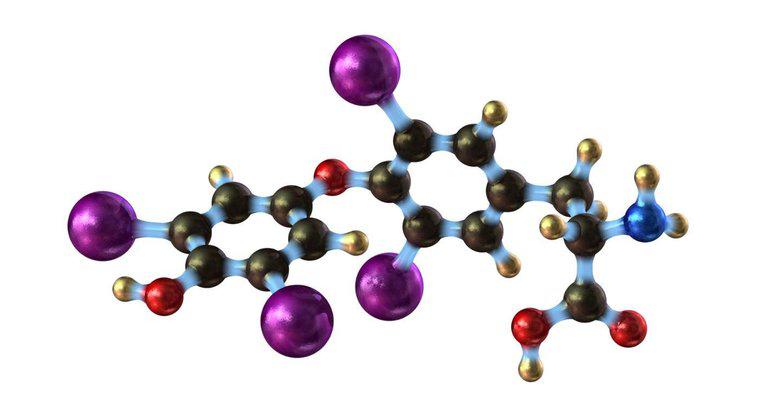
Quando lo iodio viene riscaldato, i legami intermolecolari si rompono e lo iodio passa direttamente al vapore da una solida forma cristallina. Questo perché i legami sono troppo deboli per sostenere la forma liquida in tali condizioni (leggermente sopra temperatura ambiente e pressione atmosferica standard). Se continuassi a riscaldare lo iodio, alla fine si scioglierebbe a 113 gradi Celsius, e bollirebbe a 185 gradi C.
L'acqua è ampiamente utilizzata per illustrare i tre stati comuni della materia: solido, liquido e gas. Con l'applicazione del calore, i legami intermolecolari si rilassano e si forma acqua liquida. Con ancora più calore applicato, i legami si rilassano ulteriormente e l'acqua evapora. La stessa transizione può essere osservata nella maggior parte delle sostanze trovate sulla Terra.
Lo iodio non segue questo schema comune, perché i legami intermolecolari in forma solida non sono così forti come nella maggior parte delle altre sostanze. Alla pressione atmosferica standard, quando si applica un calore minimo, le molecole di iodio sono in grado di liberarsi completamente dalla forma solida, diventando invece vapore. Quando lo iodio viene ulteriormente riscaldato, la pressione del vapore aumenta (la quantità di gas in equilibrio con lo stato solido o liquido). Aumentando la temperatura aumenta anche la pressione del vapore, fino a quando lo iodio si scioglie e poi bolle.