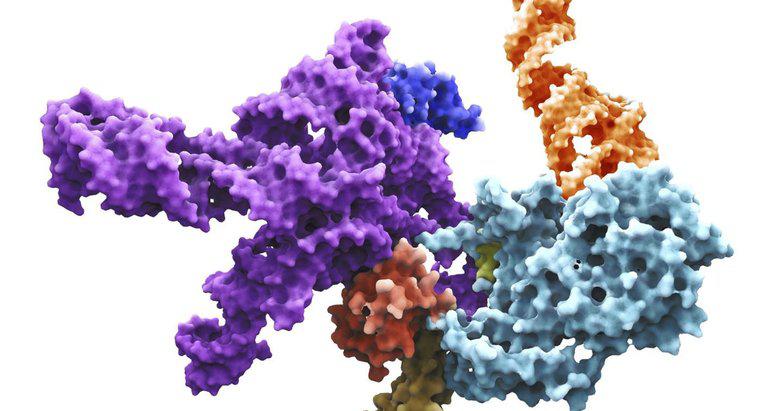
Il modello lock-and-key si riferisce al modo in cui un substrato si lega al sito attivo di un enzima. Simile a come una chiave deve essere quella corretta per un lucchetto, non avviene alcuna reazione se un substrato non corretto tenta di legarsi.
Il sito attivo di un enzima è una regione specifica che riceve il substrato. Possiede una forma unica che completa quella del substrato, consentendo la specificità di uno o due composti. Il substrato si lega al sito attivo e si verifica una reazione che alla fine causa il rilascio del prodotto formato. Gli enzimi catalizzano questa reazione facilitando i cambiamenti del legame chimico nel substrato alterando la distribuzione degli elettroni. Una volta che il prodotto è stato rilasciato, l'enzima si rigenera, pronto per un altro ciclo di reazione.
L'analogia lock-and-key vede questo processo come molto specificato, nel senso che solo una chiave particolare può entrare nel buco della serratura. Se la chiave è più piccola, più grande o semplicemente di una forma diversa, allora non si adatta al buco della serratura, e una reazione non può aver luogo. Questa analogia lock-and-key fu descritta per la prima volta da Emile Fischer nel 1894, e da allora ci sono state altre teorie per spiegare la meccanica delle reazioni enzimatiche.