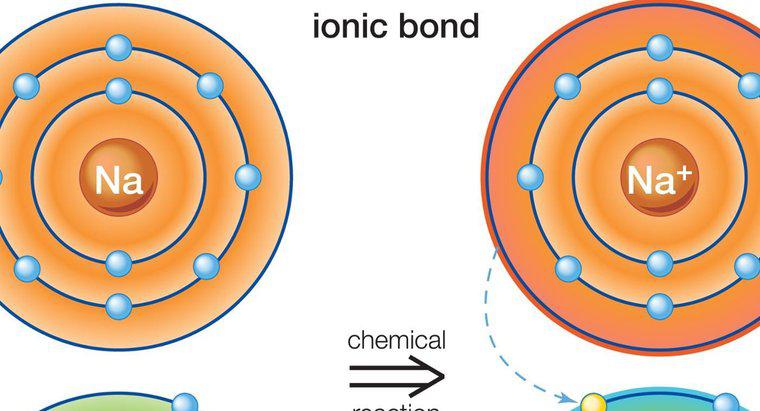
Le soluzioni acquose di composti ionici sono buoni conduttori di elettricità mentre le soluzioni di composti molecolari non lo sono. Questo è vero perché i singoli ioni nei composti ionici possono completamente dissociarsi in acqua con le molecole che rimangono intere. I composti ionici e molecolari influenzano anche i punti di ebollizione e fusione dell'acqua.
I composti ionici si sciolgono più facilmente in acqua rispetto ai composti molecolari, sebbene ci siano eccezioni a questa regola. L'acqua è usata come standard per determinare la solubilità di un composto perché è altamente polare e può sciogliere più composti di qualsiasi altro solvente, dandogli il titolo del solvente universale. I composti ionici conducono elettricità quando si dissociano perché facilitano il trasferimento di elettroni. La differenza nelle cariche delle particelle consente agli elettroni liberi di passare facilmente dalla particella alla particella. Le molecole condividono i loro elettroni e hanno una carica neutra generale che non consente molta conduttività.
I composti ionici hanno punti di fusione e di ebollizione elevati, mentre i composti molecolari hanno punti di fusione e di ebollizione relativamente bassi. Queste proprietà si trasferiscono all'acqua quando i composti si dissolvono in esso. Composti ionici dissociati aumentano il punto di fusione e abbassano il punto di congelamento dell'acqua. I composti molecolari generalmente hanno l'effetto opposto se si dissolvono in acqua.