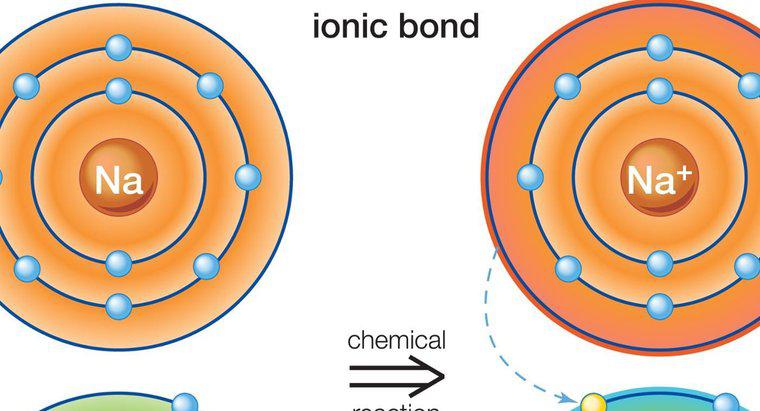
La denominazione dei composti ionici richiede una corretta identificazione del catione e delle specie anioniche presenti. In alcuni casi, la carica dello ione è importante per una denominazione accurata.
I principi di denominazione della chimica standard identificano il catione prima nel nome e nell'altro secondo. Nei composti ionici, il catione è tipicamente un metallo, e la prima parte del nome del composto è semplicemente quel metallo. Se il catione può esistere naturalmente in più stati caricati, la carica del metallo, nota anche come valenza, dovrebbe essere identificata nel nome composto con numeri romani. Ad esempio, il ferro può esistere nello stato positivo a due o tre carichi positivi. Questi sarebbero chiamati ferro (II) e ferro (III), rispettivamente.
Il passo finale nella denominazione di un composto ionico è identificare correttamente l'anione che è presente. Gli anioni possono essere un ione singolo, come il bromuro o molecole complesse composte da più atomi, come il solfato. Per questi anioni complessi, sono disponibili parametri di denominazione aggiuntivi. Gli elementi che sono in grado di formare ossianioni multiple, come azoto e zolfo, hanno una desinenza anite o a-a, a seconda del numero di molecole di ossigeno presenti. Un esempio di un composto ionico propriamente detto è il solfato di ferro (II) per la formula ionica Fe (SO4).