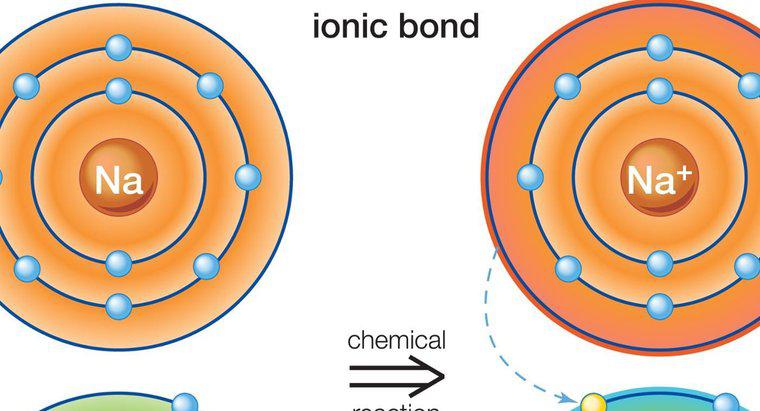
Un legame ionico è un tipo di legame chimico stabilito tra due atomi mediante il trasferimento degli elettroni di valenza da un atomo all'altro. Questo tipo di legame è anche noto come legame elettrovalente o polare. I sali sono un buon esempio di sostanze fatte con il legame ionico.
Un legame ionico coinvolge un metallo e un atomo non metallico. Ogni atomo ha la tendenza a raggiungere la configurazione di elettroni stabile, il che significa ottenere il numero di ottetti (2 o 8) al suo guscio di valance. L'atomo di metallo ha elettroni in eccesso sopra il numero di ottetti nel suo guscio di valance. D'altra parte, l'atomo non metallico è a corto di elettroni e quindi ha bisogno di elettroni per soddisfare il suo ottetto. Una volta che si incontrano, l'atomo di metallo arrende i suoi elettroni in eccesso all'atomo non metallico. Come risultato di questo trasferimento di elettroni, ciascuno degli atomi raggiunge la configurazione di elettroni stabile. Il composto è formato da questo legame chiamato composto ionico o elettrovalente. Nei legami ionici, la carica netta del composto deve essere zero. Alcuni esempi di composti ionici sono: NaCl (sodio cloruro), MgO (ossido di magnesio), CaF2 (fluoruro di calcio) e Al2O2 (ossido di alluminio). Nel mondo reale non è noto che esistano composti con legame ionico puro. Tutti i composti ionici hanno un grado di legame covalente.