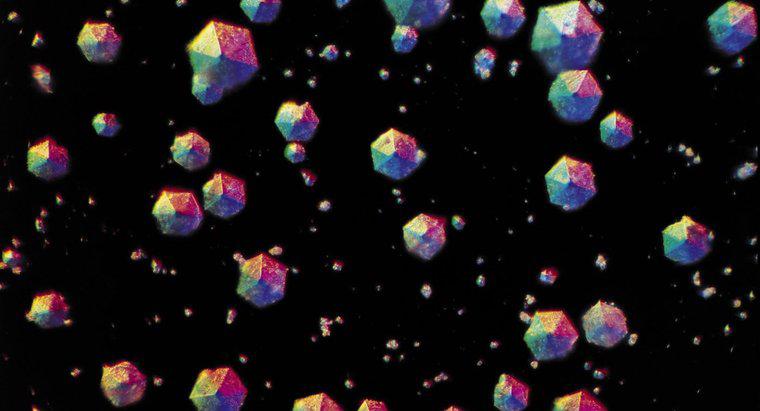La cristallizzazione separa un solido disciolto in un liquido che ha formato una soluzione. Per cristallizzare il solido, la soluzione viene riscaldata in un contenitore aperto per consentire al liquido di evaporare, lasciando il solido cristallino dietro.
La cristallizzazione può essere indotta naturalmente o artificialmente. Oltre ai cristalli che precipitano da una soluzione liquida, la cristallizzazione può avvenire anche in un liquido fuso che viene raffreddato o un gas che si deposita su una superficie. La cristallizzazione avviene in due fasi principali: nucleazione e crescita dei cristalli.
Durante la fase di nucleazione, le molecole di solvente disperse nella soluzione sono attratte l'una dall'altra, formando cluster di dimensioni nanometriche. Arrestare il processo in questa fase e stabilizzare i nanocluster è una tecnica comunemente usata nella sintesi di nanoparticelle. Lasciare il processo per continuare produce nuclei stabili che persistono senza dissolversi nella soluzione. Le dimensioni critiche che questi nuclei devono raggiungere per diventare stabili dipendono dalle condizioni del sistema come la temperatura della soluzione e la concentrazione del solvente.
Lo stadio di crescita dei cristalli comporta la successiva attrazione di ulteriori molecole di solvente nei nuclei che sono già riusciti a raggiungere dimensioni critiche. Questo processo continua finché la soluzione è supersatura: avere più solvente disciolto di quello che può sostenere in queste particolari condizioni.