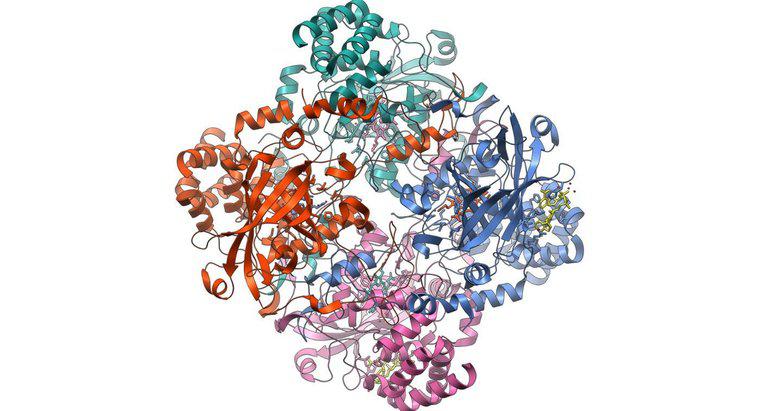
L'emoglobina lega l'ossigeno arrugginendo a livello atomico. La molecola dell'emoglobina nei globuli rossi è quella che l'Office of Science dell'Ufficio del Dipartimento dell'Energia definisce una "metalloproteina". Cioè, è una proteina che incorpora del metallo, ferro in questo caso, nella sua struttura. Ogni molecola di emoglobina trasporta quattro atomi di ferro legati che lavorano in modo cooperativo per trasportare l'ossigeno dai polmoni, dove è abbondante, ad altre parti del corpo.
Secondo il sito web del National Centre for Biotechnology Information, gli atomi di ferro trasportati dall'emoglobina reagiscono alla presenza di ossigeno nello stesso modo in cui di solito il ferro fa, legandosi ad esso in un processo chiamato ossidazione. Il composto risultante, l'ossido di ferro, è chiamato ruggine quando viene trovato all'esterno del corpo. All'interno dei globuli rossi, queste molecole di emoglobina ossidate si attaccano al loro carico di ossigeno fino a quando non raggiungono una parte del corpo che non ha abbastanza ossigeno, da dove viene poi rilasciato.
Lo stesso articolo osserva che le quattro subunità della molecola dell'emoglobina lavorano insieme per legare l'ossigeno in modo molto efficiente in ambienti ricchi di ossigeno, ma l'effetto si indebolisce in ambienti poveri di ossigeno. Questa reazione irregolare rende l'emoglobina desiderosa di legarsi con l'ossigeno nei polmoni e altrettanto desiderosa di separarsene in presenza di una cellula affamata di ossigeno, dopodiché il ciclo ricomincia.