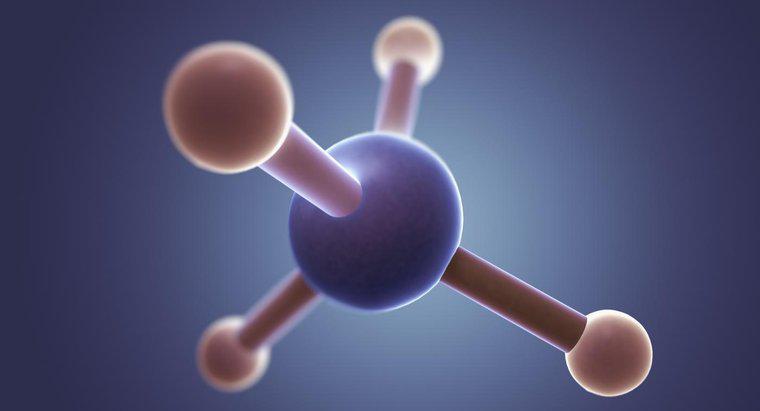
La struttura a punti di Lewis per CH2F2, la formula chimica per difluorometano, è una C al centro con linee su ciascun lato rispetto alle due H e alle due F. Ogni H contiene 3 coppie di punti attorno ai lati non raggruppati.
Nella struttura di Lewis, la C rappresenta il carbonio, la H rappresenta i due atomi di idrogeno, la F rappresenta i due atomi di fluoro, i punti rappresentano gli elettroni e le linee rappresentano una coppia di elettroni legati. Ogni atomo di fluoro contiene sette elettroni di valenza. Questo numero può essere determinato dalla colonna del fluoro sulla tavola periodica. Ogni atomo di carbonio ha quattro elettroni, mostrato anche dalla sua colonna sulla tavola periodica. Per legare con due atomi di fluoro, l'atomo di carbonio deve creare un legame singolo con ciascun atomo di fluoro, utilizzando i suoi elettroni di valenza. Uno dei sette elettroni di valenza degli atomi di fluoro si lega al singolo elettrone dall'atomo di carbonio, lasciando ciascun atomo di fluoro con sei elettroni di valenza rimasti non legati. Nella struttura a punti di Lewis, questi elettroni rimanenti sono rappresentati da punti posti equamente attorno al simbolo degli elementi. Per verificare l'accuratezza della struttura del punto di Lewis, gli studenti possono contare tutti gli elettroni, contando ogni punto come un elettrone e ogni legame come due elettroni. Il numero di elettroni nella struttura dovrebbe essere uguale al numero di elettroni in CH2F2.