L'emoglobina è una molecola proteica complessa composta da quattro subunità di polipeptidi, o globine, che sono catene di amminoacidi. Queste subunità globiniche si legano a gruppi eme non ptorein contenenti uno ione ferro che può legarsi all'ossigeno. Questi ioni di ferro sono a loro volta racchiusi in anelli chiamati porfirine.
Poiché l'emoglobina contiene ferro, è considerata una metalloproteina. Quattro atomi di azoto nell'anello di porfirina funzionano con lo ione ferro. Quando lo ione ferro si lega con l'ossigeno, diventa un colore rosso più profondo.
L'emoglobina ha due proteine che gli permettono di trasportare e rilasciare ossigeno. Negli adulti, sono alfa globina e beta globina, ma durante la gravidanza, la gamma globina agisce invece della beta globina nell'emoglobina fetale.
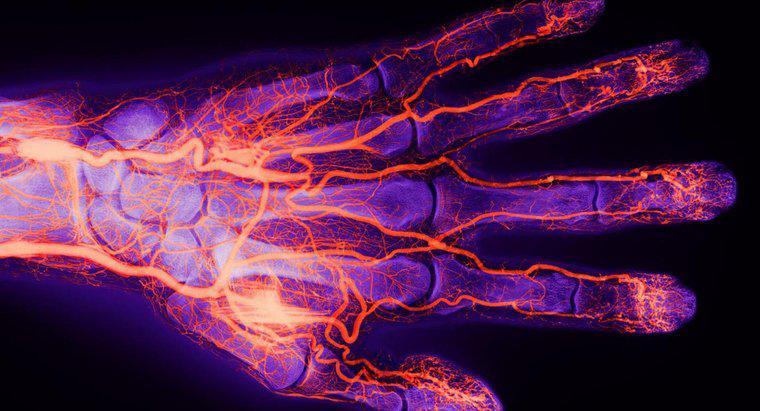
Quando i globuli rossi entrano negli alveoli, l'emoglobina al loro interno si combina con l'ossigeno per formare l'ossiemoglobina. Mentre le cellule del sangue circolano attraverso il resto del corpo, l'emoglobina rilascia l'ossigeno ai tessuti. La parte globina dell'emoglobina raccoglie il biossido di carbonio, un materiale di scarto, e lo rilascia negli alveoli. L'emoglobina può trasportare ossigeno e carbondioxide contemporaneamente.
I globuli rossi sono costituiti quasi interamente da emoglobina, ma l'emoglobina si trova anche in neuroni, alveoli e globuli bianchi chiamati macrofagi.