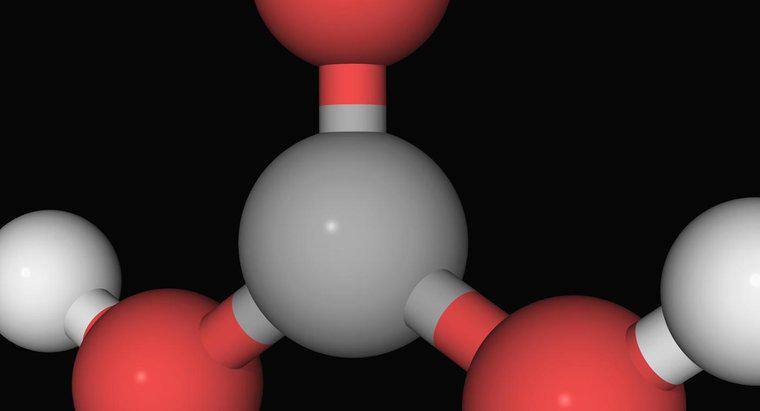
La definizione di Arrhenius di un acido è un composto che aumenta il numero di ioni di idrogeno carichi positivamente, H +, quando aggiunti all'acqua. Secondo Arrhenius, una base è qualsiasi sostanza che si traduce nell'aumento di ioni di idrossido negativamente caricati, OH-, quando combinato con acqua.
Queste definizioni furono sviluppate nel 1884 da Svante Arrhenius, un chimico svedese.
La definizione di acidi e basi di Arrhenius è una delle due definizioni regolarmente accettate. L'altra è la definizione Bronsted-Lowry, che descrive un acido come qualsiasi composto che emette protoni in una soluzione acquosa e una base come composto che accetta protoni aggiuntivi.