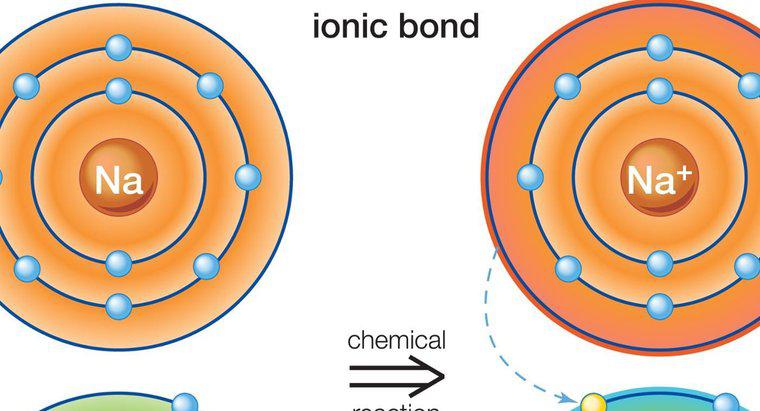
Poiché sono il risultato dell'attrazione tra cariche parziali piuttosto che cariche complete, i legami idrogeno sono molto più deboli dei legami ionici o covalenti. I legami ionici e covalenti attirano gli atomi di diverse sostanze insieme per formare le molecole dei composti, mentre i legami idrogeno sono forze che tendono ad attrarre le molecole l'una dall'altra. Un esempio di legame con l'idrogeno è l'attrazione tra le singole molecole d'acqua mentre l'attrazione tra gli atomi di idrogeno e ossigeno all'interno di ogni molecola d'acqua rappresenta il legame covalente.
Un legame idrogeno si forma quando un atomo di idrogeno polarizzato positivamente in una molecola viene attratto da un atomo altamente elettronegativo in un'altra molecola. Nell'esempio delle molecole d'acqua, l'atomo di ossigeno caricato negativamente in una molecola d'acqua attira l'atomo di idrogeno caricato positivamente in un'altra molecola d'acqua. Gli atomi di ossigeno tendono a rubare gli elettroni lontano dagli atomi di idrogeno all'interno delle molecole. Quando ciò avviene all'interno di una molecola d'acqua, la perdita di elettroni crea un atomo di idrogeno con una carica positiva parziale, che viene quindi attratta da un atomo di ossigeno caricato negativamente in un'altra molecola d'acqua.
I legami di idrogeno che si formano tra le molecole d'acqua li fanno aderire insieme. Questo dà all'acqua una temperatura di ebollizione elevata perché è necessario un maggiore grado di energia termica per rompere i legami idrogeno intermolecolari. Molte sostanze organiche che sono necessarie per sostenere la vita, come gli acidi nucleici e le proteine, contengono legami idrogeno. Sebbene questi legami siano più deboli dei legami ionici o covalenti interni esistenti tra gli atomi all'interno delle molecole, la forza accumulata dei legami di idrogeno all'interno degli organismi viventi è altamente significativa e svolge un ruolo importante nel mantenimento della stabilità.