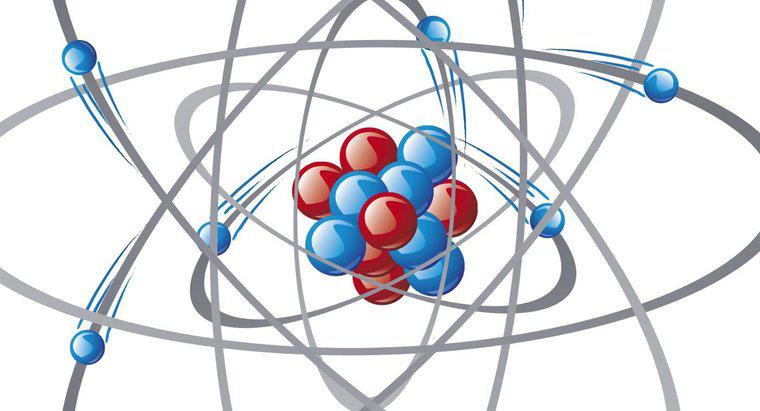
Un atomo senza carica si carica positivamente quando perde un elettrone. Quando questo accade, si chiama ione positivo. Se l'atomo guadagna un elettrone, l'atomo diventa uno ione negativo. In entrambi i casi, il numero di protoni nel nucleo dell'atomo non cambia. Più di un elettrone può essere rimosso da un atomo per dargli una carica positiva di +2, +3 o più.
L'addizione e la sottrazione di elettroni caricati negativamente possono facilmente cambiare la carica di un atomo, perché ruotano continuamente in gusci di valenza al di fuori del nucleo. È più facile per un atomo vicino condividere o rubare un elettrone piuttosto che un protone caricato positivamente, che si trova nel nucleo. Richiede un forte apporto di energia per dividere un protone libero da altri protoni e neutroni.
A causa della loro composizione chimica, gli elementi che sono considerati come i metalli più facilmente perdono elettroni per diventare ioni positivi. I non metalli guadagnano elettroni e diventano ioni caricati negativamente. I metalli sono organizzati sulla tavola periodica in gruppi, che corrispondono al numero di elettroni che perdono per diventare stabili nel loro guscio di valenza più esterno. Ad esempio, l'alluminio (Al) si trova nel Gruppo 3 e perderà tre elettroni da trasformare in uno ione con una carica di +3.