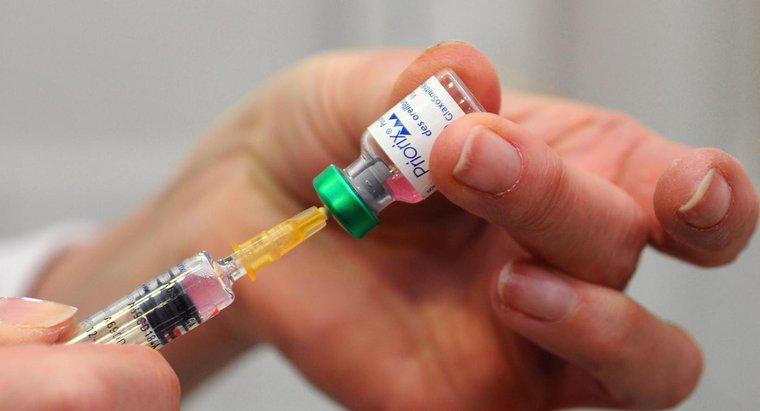
Un'applicazione pratica della legge di Boyle è il prelievo di un liquido in una siringa. Tirando indietro lo stantuffo aumenta il volume interno della siringa e riduce la sua pressione. Il fluido fuori dalla siringa viene aspirato nella canna finché la pressione interna ed esterna non sono bilanciate.
La legge di Boyle afferma che il volume e la pressione di un gas o di un liquido rimangono costanti se la temperatura della sostanza rimane la stessa. Questa legge, che fu dichiarata per la prima volta da Robert Boyle nel 17 ° secolo, è di vitale importanza in applicazioni ingegneristiche come la progettazione di motori. La sua formula è V1 /V2 = P2 /P1 (a temperatura costante), dove V1 è il volume iniziale, V2 è il volume modificato, P1 è la pressione iniziale e P2 è la pressione modificata.
La legge più strettamente legata alla legge di Boyle è la legge di Charles, o la "legge dei volumi", che è opera dello scienziato francese Jacques Charles. Descrive la relazione tra volume e temperatura. Sia la legge di Boyle che la legge di Charles sono teorie del gas che descrivono il comportamento di un ipotetico gas "ideale". In pratica, tuttavia, entrambi si applicano anche ai liquidi. La legge di Boyle è talvolta chiamata legge di Mariotte, un riferimento al ricercatore francese che ha scoperto gli stessi principi 14 anni dopo la pubblicazione di Boyle. Questa convenzione di denominazione è popolare in Francia e in altre nazioni europee.