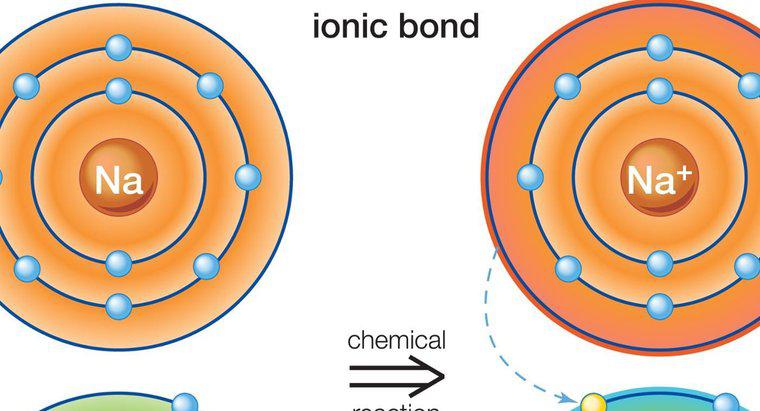
Gli atomi coinvolti nel legame ionico sono tenuti insieme da una forza elettrostatica di attrazione tra uno ione positivo e uno negativo. I legami ionici si formano solo tra metalli e non metalli.
Il legame ionico si verifica in presenza di uno ione positivo e uno negativo. Gli ioni si formano quando gli atomi neutri perdono o ottengono un elettrone. Tutti gli atomi perdono o ottengono elettroni per ottenere una configurazione di elettroni stabile. I gas più stabili e nobili hanno tutti otto elettroni nei loro gusci più esterni, con l'eccezione dell'elio, che ha solo due elettroni. Quando un atomo ha otto elettroni nel suo guscio esterno, si dice che abbia una struttura di ottetto stabile.
I metalli hanno da uno a tre elettroni nei loro gusci esterni, il che impedisce loro di formare una struttura di ottetto stabile. È più facile per gli atomi perdere gli elettroni per rivelare un guscio sottostante con otto elettroni, piuttosto che ottenere elettroni per completare la struttura dell'ottetto. Pertanto, i metalli formano ioni positivi. I non-metalli, tuttavia, tendono a guadagnare uno o più elettroni per completare l'ottetto nel loro guscio più esterno, e quindi tendono a formare ioni negativi.
I metalli possono donare i loro elettroni a non metalli. Poiché le cariche sugli ioni sono diverse (ioni caricati opposti), l'atomo di metallo caricato positivamente è trattenuto sull'atomo non metallico a carica negativa con una forte forza elettrostatica di attrazione.