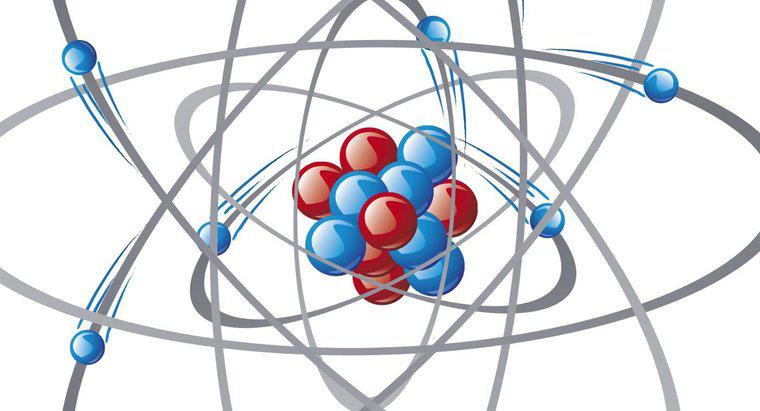
In un legame ionico, un elettrone lascia un atomo per unirsi a un altro, mentre un legame covalente è una condivisione di elettroni tra due atomi. I legami covalenti polari si verificano quando due atomi condividono un numero irregolare di elettroni .
I legami chimici si formano a causa delle interazioni tra gli elettroni di valenza negli atomi. Gli elettroni di valenza occupano l'involucro più esterno o il livello di energia di un atomo. Se il guscio di valenza è riempito con il numero massimo di possibili elettroni, è un guscio chiuso. Gli atomi con gusci chiusi tendono ad essere inerti e difficilmente reagiscono con altri atomi e molecole. Gli atomi con gusci di valenza aperti possono ricevere, donare o condividere elettroni per formare un guscio chiuso.
I legami ionici implicano il trasferimento completo di elettroni da un atomo all'altro e richiedono un donatore e un ricevitore. Gli atomi con pochi elettroni nell'involucro più esterno hanno maggiori probabilità di donare, mentre gli atomi con molti elettroni di valenza spesso ricevono più per formare un guscio chiuso. Il legame ionico porta alla formazione di due atomi caricati, o ioni. Un esempio è il sale o il cloruro di sodio. Gli atomi di sodio donano prontamente elettroni, il che si traduce in una carica positiva. Gli atomi di cloro accettano questi elettroni, diventando carichi negativamente. I due atomi caricati opposti si attraggono l'un l'altro per formare una molecola di cloruro di sodio.
Alcuni atomi condividono gli elettroni per ottenere un guscio chiuso; questo è chiamato legame covalente. Gli atomi di ossigeno, ad esempio, richiedono due elettroni aggiuntivi per formare un guscio chiuso, mentre gli atomi di idrogeno ne richiedono uno. Un atomo di ossigeno condivide prontamente due dei suoi elettroni con atomi di idrogeno in modo che tutti e tre gli atomi abbiano gusci chiusi. La disposizione crea una molecola d'acqua. Tuttavia, l'ossigeno esercita un'attrazione maggiore sugli elettroni rispetto a quanto fa l'idrogeno; quindi, gli elettroni condivisi trascorrono più tempo attorno all'atomo di ossigeno che attorno agli atomi di idrogeno. L'atomo di ossigeno porta quindi una carica parziale negativa, e gli atomi di idrogeno portano ciascuno una carica parziale positiva. Il legame che determina questa carica ineguale è chiamato legame covalente polare.