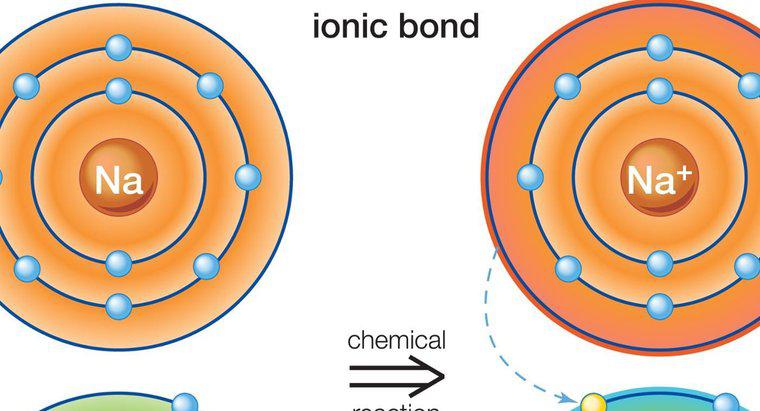
I composti ionici sono solidi, possiedono alti punti di fusione, conducono elettricità, sono duri ma fragili e sono formati da un legame ionico tra un metallo e uno non metallico. Un legame ionico è un legame tra due elementi con cariche opposte. Le cariche opposte si attraggono l'un l'altra, creando un forte legame chimico.
I composti ionici si dissolvono facilmente nei solventi polari, come l'acqua. Non si dissolvono facilmente in solventi non polari, che includono etere e benzina. Questo perché i composti ionici tendono a formare molecole polari, che si dissolvono in soluzioni di polarità simile. Un solvente non polare non fornisce energia sufficiente per rompere il legame ionico e sciogliere la struttura cristallina del composto.
Le proprietà conduttive dei composti ionici si applicano quando vengono dissolte in una soluzione ionica o quando vengono sciolte. Quando i composti ionici sono solidi, sono isolanti elettrici piuttosto che conduttori. Questo perché le cariche elettriche non possono passare attraverso la struttura a reticolo stretto di un composto ionico allo stato solido.
Cloruro di sodio, noto anche come sale da cucina; cloruro di potassio, che è usato in medicina e come sostituto del sale; e il corindone, il minerale di cui sono composti i rubini e gli zaffiri, sono composti ionici ben noti. Tutti questi composti formano strutture cristalline, un'altra caratteristica comune dei composti ionici.