La forma di una proteina è determinata dai quattro livelli della struttura proteica: primaria, secondaria, terziaria e quaternaria. Altre proteine chaperon sono presenti nella cellula e assicurano che una proteina si piega nella sua forma corretta.
Le proteine sono composte da polipeptidi in cui una sequenza di amminoacidi collegata attraverso legami peptidici. Questa sequenza è indicata come una struttura primaria delle proteine. La struttura primaria è più spesso riportata attraverso una lettera o tre lettere di abbreviazioni per gli amminoacidi, elencati a partire dal lato N-terminale. La struttura secondaria è un segmento regolarmente piegato di una proteina formata attraverso legami a idrogeno tra gli atomi di backbone degli amminoacidi. I due principali tipi di strutture secondarie sono le alfa e le beta. Una alfa elica contiene 3,6 aminoacidi per giro elicoidale. L'amminoacido prolina non si adatta all'interno di un'elica a causa della sua struttura rigida. I fogli beta contengono catene di legami peptidici che si allineano l'uno di fianco all'altro. Possono essere sia paralleli, in cui entrambi i fili si allineano in senso direzionale, sia in modo uniforme, in cui ogni foglio è diretto opposto.
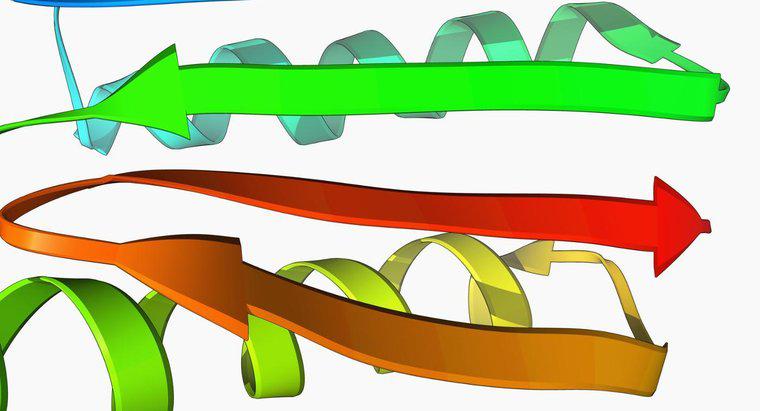
La struttura terziaria è la struttura tridimensionale dell'intera catena peptidica. Nei diagrammi delle proteine, le eliche alfa sono generalmente mostrate come bobine e i fogli beta sono mostrati come un nastro piatto. La struttura terziaria è mantenuta dalle interazioni di una catena laterale di amminoacidi determinata dalle loro caratteristiche. La struttura quaternaria è presente nelle proteine che contengono più di una catena polipeptidica, indicata come dominio. È la disposizione spaziale dei domini.