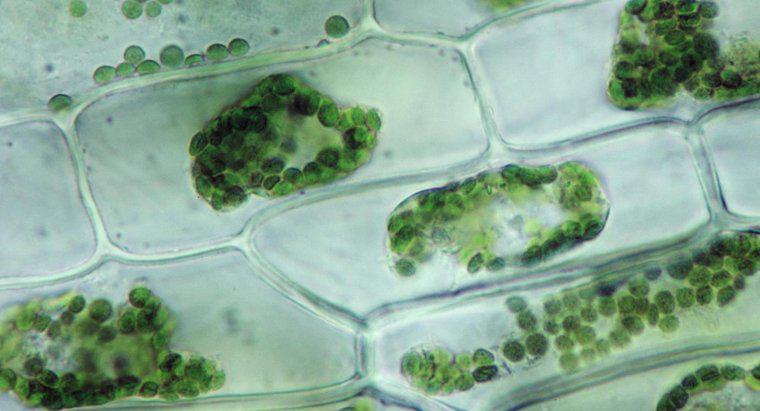
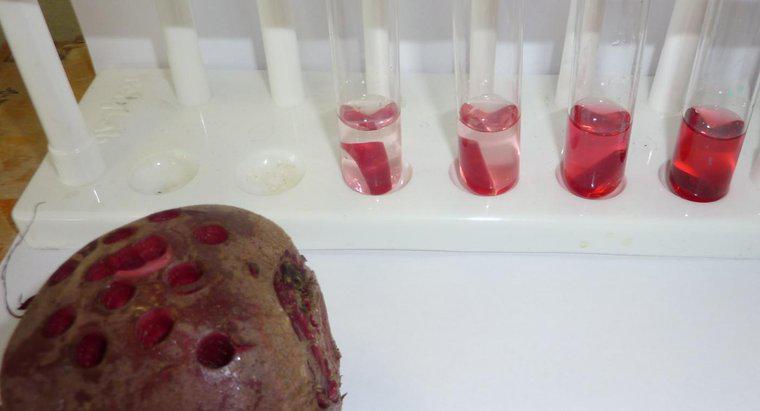
L'osmosi è un tipo particolare di diffusione in cui l'acqua attraversa una membrana semipermeabile in un'area con una maggiore concentrazione di soluto, mentre la diffusione standard spesso consente il libero movimento di entrambi i soluti e il solvente verso l'equilibrio. La diffusione in generale è il movimento netto di molecole in soluzione da aree di concentrazione superiore a aree di concentrazione inferiore. La pressione osmotica è potenzialmente molto potente, poiché la pressione osmotica è l'unica forza necessaria per spostare l'acqua dalle radici alle cime degli alberi più alti del mondo.
Quando l'acqua dissolve un'altra sostanza, è perché le molecole d'acqua polare e il soluto si attraggono l'un l'altro. Ogni atomo, ione o molecola di soluto ha una carica in almeno una regione che attrae un lato o l'altro della molecola d'acqua. In quanto tale, quante più molecole d'acqua possibile tendono a riunirsi attorno a ciascuna particella di solvente. Nell'acqua liquida, tutte le molecole sono in costante movimento casuale l'una intorno all'altra. Tuttavia, a causa dell'attrazione, le molecole d'acqua hanno una maggiore probabilità di muoversi verso le particelle di soluto rispetto a quelle che sono lontane da esse e le particelle di soluto hanno maggiori probabilità di muoversi verso le molecole d'acqua rispetto ad altre particelle di solvente. Questo movimento netto risulta, gradualmente, in una distribuzione uniforme del soluto. Nell'osmosi, solo le molecole d'acqua possono muoversi per uniformare le concentrazioni.