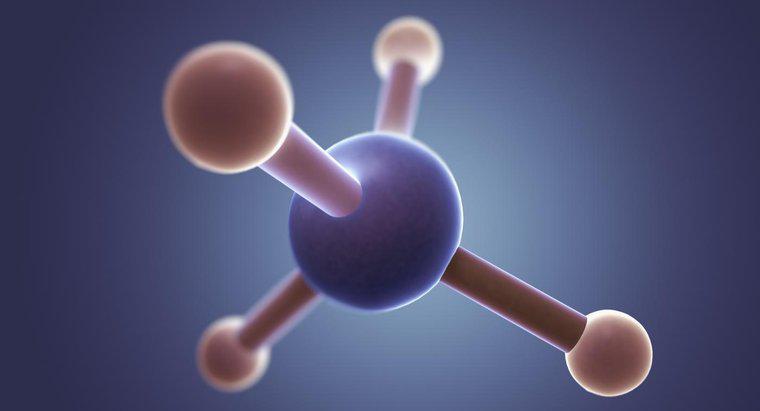
La struttura di Lewis per CH3Br ha il carbonio al centro con quattro elettroni attorno ad esso e i tre idrogeni e il bromo condividono ciascuno un singolo elettrone con il carbonio. Il bromo ha altre tre coppie di elettroni circondandolo
Le strutture di Lewis mostrano come gli atomi si legano l'un l'altro per formare una molecola completa, e sono utili per dimostrare l'adesione in molecole di base, come il bromometano. In alcuni casi, le linee sono utilizzate per indicare i legami, ma i punti sono più comuni quando si tratta di composti di base. Oltre agli elettroni di legame, questi diagrammi mostrano anche elettroni non legati, come nel caso del bromo in bromometano. Il bromo, in questo caso, ha tre coppie di elettroni che non sono coinvolti attivamente nel legame tra esso e il carbonio.
In generale, le strutture di Lewis dimostrano che la maggior parte degli atomi, ad eccezione dell'idrogeno, formano molecole per ottenere un totale di otto elettroni nei loro gusci esterni. Tuttavia, queste strutture possono anche essere utilizzate per suggerire la forma generale di una molecola. Nel caso del bromometano, i quattro atomi attorno al carbonio devono essere disposti in modo abbastanza uniforme in uno spazio tridimensionale, in modo da formare una struttura tetraedrica. Tuttavia, poiché il bromo forma un legame così lungo (e quindi più debole), gli idrogeni hanno un po 'più di spazio rispetto al metano, risultando in un tetraedro leggermente distorto.