Il legame all'idrogeno coinvolge gli spostamenti di dipolo creati da legami polari e avviene tra molecole contenenti legami polari. L'idrogeno è specificamente coinvolto perché l'elemento ha una bassa elettronegatività per un non metallo e crea un ampio spostamento di dipolo che è abbastanza forte da attrarre altri atomi elettronegativi dai legami polari in altre molecole.
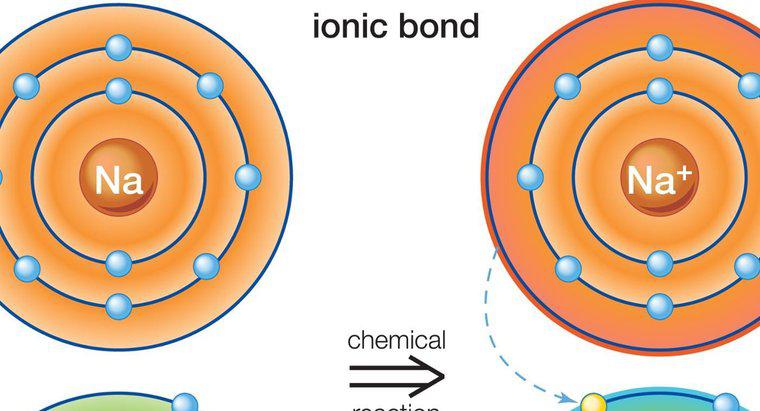
I legami covalenti polari si formano quando i due atomi di legame hanno una differenza di elettronegatività che è abbastanza significativa da creare uno spostamento in carica ma è inferiore alla differenza richiesta per formare un legame ionico. In un legame covalente polare, gli atomi condividono gli elettroni in modo non uniforme. Questo crea uno spostamento di dipolo e dà a un'estremità una carica leggermente positiva e l'altra a una carica leggermente negativa.
Quando l'idrogeno è coinvolto in un legame polare, diventa leggermente positivamente carico e attrae dipoli caricati negativamente da altre molecole. L'altra molecola non ha bisogno di essere polare in generale, ma deve avere legami polari per formare i dipoli che attraggono o respingono le cariche di idrogeno. Il legame all'idrogeno è una forma di legame più debole rispetto ai legami ionici o covalenti, ma è abbastanza significativo da creare proprietà uniche e forze attrattive, come quelle viste tra le molecole d'acqua.