I composti ionici e molecolari differiscono principalmente nel modo in cui sono formati. I composti ionici si formano attraverso il trasferimento di elettroni, mentre i composti molecolari si formano come risultato della condivisione elettronica.
I composti ionici contengono atomi e molecole con cariche opposte. Legano insieme come risultato delle loro cariche opposte. Ad esempio, un legame ionico negativamente abbinato con uno ione positivo. Atomi e molecole con cariche simili si respingono a vicenda. Le molecole con carica positiva sono chiamate cationi e le molecole con carica negativa sono chiamate anioni.
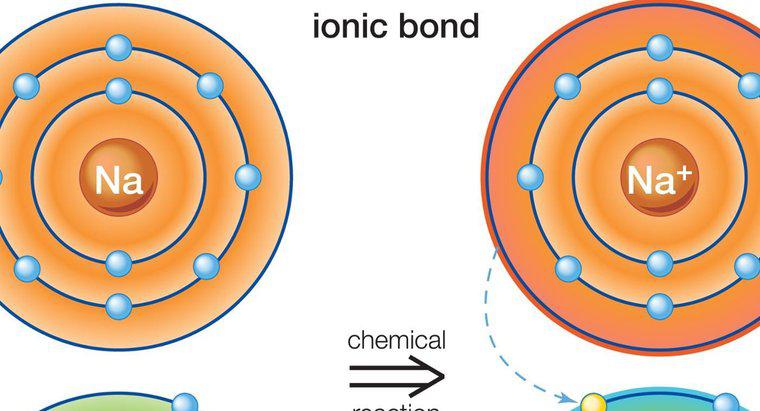
Composti ionici
I composti ionici si formano come conseguenza di atomi o molecole che attraggono più atomi o molecole con una carica opposta. La composizione varia a seconda del tipo di composto, ma tutti i composti ionici devono avere una carica elettrica neutra. Ciò significa che devono avere un uguale rapporto di molecole anioniche e cationiche.
I composti ionici sono in genere solidi. Possono essere fatti di singoli atomi, chiamati composti monatomici o più atomi, che li rende composti poliatomici. Il legame ionico, che forma molecole ioniche, comporta il trasferimento di elettroni da metalli a non metalli. I metalli tendono a perdere elettroni positivi prontamente perché hanno pochi elettroni nel loro livello di energia esterna. I non metalli hanno più elettroni negativi nel loro livello di energia esterna. Di conseguenza cercano ioni positivi e si legano naturalmente con le molecole metalliche. La maggior parte dei composti poliatomici è anionica, con l'eccezione del catione di ammonio. I composti ionici differiscono dai composti molecolari in quanto possono formarsi da metalli e non metalli, mentre i composti molecolari possono formarsi solo da non metalli. I comuni tipi di composti ionici sono sale e zucchero.
Composti molecolari
I composti molecolari, chiamati anche composti covalenti, condividono gli elettroni formando legami covalenti. Mentre i composti ionici possono essere costituiti da atomi e molecole metalliche e non metalliche, i legami covalenti possono formarsi solo da atomi e molecole non metallici. Un composto covalente si forma quando gli atomi all'interno di diversi elementi sono combinati attraverso molecole. Questo legame consente la condivisione di elettroni di valenza, che crea un'attrazione comune che tiene insieme gli atomi nella molecola.
I composti covalenti variano in misura considerevole. Alcuni sono piccoli, con pochi elementi, mentre altri possono avere migliaia di atomi. Poiché condividono gli elettroni invece di scambiarli, i composti covalenti hanno proprietà considerevolmente differenti rispetto ai composti ionici. I composti covalenti tendono a bruciare facilmente, mentre i composti ionici no. A differenza dei composti ionici, non sono solubili in acqua. Un'altra distinzione tra i due tipi di molecole è che i composti covalenti non possono condurre elettricità, ma i composti ionici generalmente possono. A temperatura ambiente, la maggior parte dei composti covalenti sono in forma liquida o gassosa invece di apparire come solidi. Ciò è dovuto al fatto che le loro singole molecole sono più facilmente separate rispetto alle molecole di un cristallo, il che conferisce loro un punto di ebollizione relativamente basso. Composti molecolari semplici hanno la stessa struttura del nome. Si trovano nella tavola periodica nominando prima l'elemento che appare più a sinistra sul tavolo, quindi aggiungendo "ide" al secondo elemento denominato e usando i prefissi per identificare il numero di atomi in ciascun elemento. Proteine e carboidrati sono due esempi di composti molecolari. Altri composti molecolari includono gas metano, ossido di azoto e cloruro di sodio.