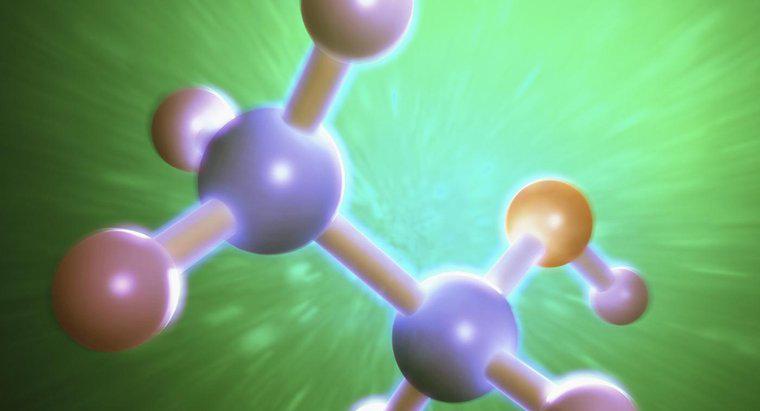
Esistono tre forze intermolecolari di etanolo. Sono dispersione di Londra, dipolo-dipolo e legame idrogeno. Tutte e tre queste forze sono differenti a causa dei tipi di legami che formano e delle loro varie forze di legame.
La prima forza, la dispersione di Londra, è anche la più debole. Nella dispersione di Londra, l'attrazione intermolecolare si verifica tra ogni molecola. Ciò è causato dallo scambio di elettroni tra ogni molecola quando sono temporaneamente polarizzati. Questa polarizzazione temporanea si verifica quando la densità elettronica è maggiore su un lato della molecola rispetto all'altra.
L'attrazione dipolo-dipolo si verifica perché l'etanolo è una molecola polare con una carica positiva e una con carica negativa. Poiché le cariche positive e negative sono attratte l'una dall'altra, i poli opposti di ogni molecola formano legami. Questa attrazione è più forte della dispersione di Londra, ma più debole del terzo tipo di attrazione, i legami di idrogeno.
La forza finale è il legame idrogeno. I legami idrogeno si verificano quando il protone si lega alla coppia di elettroni di ossigeno nella molecola. La molecola che fornisce questo legame è conosciuta come il donatore, mentre la molecola che ha gli elettroni a cui è attratto l'idrogeno è conosciuta come accettore. L'etanolo contiene il legame O-H, che consente di creare un legame idrogeno.